宫颈癌天然靶向药物研究
宫颈癌是女性第二大高发癌症, 尤其是在欠发达地区, 具有高发病率和高死亡率的特点。目前针对宫颈癌,还是以传统的手术、化疗、放疗为主要的治疗手段, 其治疗方法均具有一定的副作用和引起耐药性。虽然近年来新增了如派姆单抗、贝伐珠单抗等少量靶向治疗药物,但应用仍不是十分广泛。因此目前迫切需要开发治疗宫颈癌的新型药物。
近年来天然药物在治疗靶点和疗效等方面的优势受到较多的关注,因此,在宫颈癌治疗的基础研究方面,使用天然药物调控宫颈癌细胞自噬从而抑制肿瘤生长成为了一个新方向。
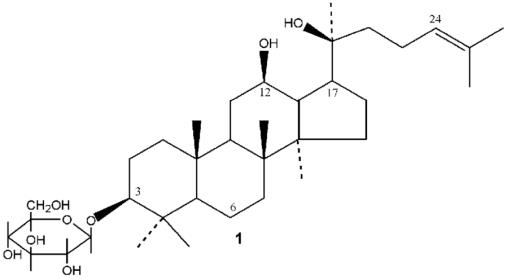
人参是一种著名的传统药用植物,在亚洲地区已广泛使用了数千年,近期在西方国家越来越受欢迎。随着现代科学技术的发展和进步,人参的研究进展迅速,特别是2000 年以来,人参的有效成分化学结构的发现到现在一百多种人参皂苷和大量非皂苷成分已被分离和确定出化学结构。
研究发现,人参皂苷具有抗肿瘤、调节免疫、有助于个体健康的维持,抗疲劳等方面功效。在人参皂苷抗肿瘤方面的研究中,发现多种人参皂苷包括Rg3,Rg5,Rh2,Compound K,Rk3 等都具有抑制肿瘤细胞增值,促进凋亡,缩小肿瘤体积等功能,其中又以人参皂苷Rh2比较具有代表性。
目前在临床医学方面主要是借助对癌细胞生长情况的抑制,来达到最终癌症治疗的目标。旨在通过细胞的自然死亡来对癌细胞生长加以全面的调节和有效的控制。在整个治疗系统之中,考虑到癌症出现的原因以及类型体现出非特异性。因此结合靶向细胞凋亡就癌症加以治疗是比较具有针对性的[1-3]。治疗靶向往往表现出两类常见方法:对促凋亡分子施加外部刺激以及进一步对抗细胞凋亡分子进行表达层面的抑制[4]。
而人参皂苷Rh2可通过调节抑制自噬溶酶体融合诱导饥饿条件下肿瘤细胞凋亡,其主要的作用机制[5]表现如下:
1、人参皂苷Rh2 抑制无血清条件下肿瘤细胞的增殖
有学者通过通过实验证实,在无血清条件下作用24 小时宫颈癌HeLa 细胞,Rh2 的IC50 浓度为 5 -7.5 μM。且此时浓度的Rh2 对正常培养条件下的HeLa 细胞增殖无影响。显微镜下观察在Rh2浓度为 5 -7.5 μM 时,HeLa 细胞生长受到限制,数量降低,形态由原来的梭形变成圆形。
为了进一步证实人参皂苷Rh2 在其他肿瘤和永生化细胞中具有作用,对宫颈癌细胞MS751(图B),宫颈癌细胞 C-33A(图C),人胚肾细胞 HEK293T(图D),肺腺癌细胞A549(图E)和小鼠黑色素瘤细胞 B16(图F)在相同的实验条件下进行测试并获得了类似的结果。这些结果表明,人参皂苷Rh2 在血清剥夺条件下能够抑制肿瘤细胞增殖。

2、 人参皂苷 Rh2 诱导细胞凋亡并调节周期
HeLa 细胞在正常或无血清条件下使用不同浓度的Rh2 作用 24 小时,之后进行流式细胞术分析。结果表明,正常培养条件下人参皂苷Rh2(0-7.5μM)对肿瘤细胞的凋亡率无影响,但无血清条件下,人参皂苷Rh2 在5-7.5 μM的浓度下会显著增加凋亡率(图A)。在细胞周期检测的结果中,人参皂苷Rh2(0-7.5 μM)不影响在正常培养条件下HeLa 细胞的细胞周期分布。在无血清条件下,人参皂苷Rh2(5 μM)对细胞周期分布具有轻微的影响,这与无血清空白组结果相似。但人参皂苷 Rh2(7.5μM)导致 S 期细胞比例降低,G0 / G1的细胞比例增加(图B)。

3、 人参皂苷Rh2 通过线粒体-AIF 途径诱导细胞凋亡
实验显示,正常培养条件下,人参皂苷 Rh2 对细胞线粒体膜电位的影响较小,但在血清剥夺细胞中(图B)能够显著降低其线粒体膜电位。这些数据表明,人参皂苷Rh2 促进无血清条件下HeLa 细胞的线粒体去极化。在无血清条件下,人参皂苷 Rh2 处理组的细胞核 AIF 水平显著高于 DMSO 对照组 AIF 的水平。并且,AIF 在细胞核的积累伴随着线粒体分布的下降,说明人参皂苷Rh2 增加了在无血清条件下线粒体中AIF 的释放和核转位。这些数据表明人参皂苷Rh2 通过线粒体-AIF 途径促进血清剥夺条件下的细胞凋亡。

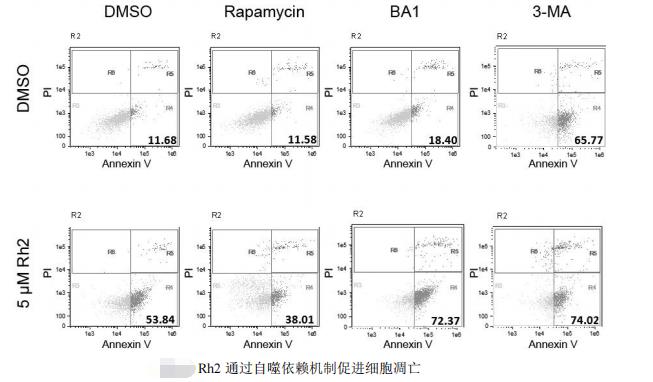
4、 人参皂苷Rh2 诱导的细胞凋亡与自噬相关
饥饿所诱导的细胞自噬可以促进细胞存活,而营养和血清补充剂的加入则会抑制自噬并且导致转录,促进细胞增殖。
类似于人参皂苷Rh2,无血清条件下添加自噬抑制剂BA1和3-MA 能够使细胞凋亡率增加,自噬抑制剂和人参皂苷Rh2 对促进HeLa细胞的凋亡有协同效应。自噬诱导剂雷帕霉素(Rapamycin)能够显著回复在无血清条件下人参皂苷Rh2 所诱导的凋亡。实验结果表明自噬在血清饥饿条件下,对人参皂苷Rh2 所诱导的细胞凋亡中起重要的作用。
综上述所,作为人参的主要活性成分人参皂苷已经被广泛研究,并且目前的研究显示Rh2具有较强的抗肿瘤活性,具有一定的应用前景。
[参考文献]
[1] Liu Y, Zhu X: Endoplasmic reticulum-mitochondria tethering in neurodegenerative diseases. Translational neurodegeneration 2017;6:21.
[2] Villa-Pulgarin JA, Gajate C, Botet J, Jimenez A, Justies N, Varela MR, Cuesta-Marban A, Muller I, Modolell M, Revuelta JL, Mollinedo F: Mitochondria and lipid raft-located fof1-atp synthase as major therapeutic targets in the antileishmanial and anticancer activities of ether lipid edelfosine. PLoS neglected tropical diseases 2017;11:e0005805.
[3] Bao H, Zhang Q, Zhu Z, Xu H, Ding F, Wang M, Du S, Du Y, Yan Z: Bhx, a novel pyrazoline derivative, inhibits breast cancer cell invasion by reversing the epithelial-mesenchymal transition and down-regulating wnt/beta-catenin signalling. Sci Rep 2017;7:9153.
[4] Zaman S, Wang R, Gandhi V: Targeting the apoptosis pathway in hematologic malignancies. Leukemia & lymphoma 2014;55:1980-1992.
[5] 边帅,人参皂苷对 HeLa 细胞凋亡和自噬的影响及作用机制研究