5倍提升!NewOrigin大模型突破超难产业任务,开启可编程生物时代新图景
2024年世界人工智能大会(WAIC)上,AI大模型再次成为备受瞩目的焦点。去年WAIC上首次亮相的AI蛋白质生成大模型NewOrigin(达尔文)亮出最新产业落地成果,并推出从产业项目中沉淀而来的五大场景解决方案。

在我国拥有显著优势的生物材料领域,AI帮助头部合成生物学公司优化极具商业价值又涉及行业瓶颈的关键蛋白质,在未使用产业场景数据的条件下,不到6个月便将其效率提升5倍,让这个已被持续改造了数十年的蛋白质有望再次实现性能跃迁,进而带动产率大幅提升、成本大幅降低,进一步提升我国在这一领域的竞争优势。
在创新药研发领域领域,AI同时针对蛋白疫苗的稳定性、表达量等进行多目标优化,动物实验显示,疫苗产生中和抗体滴度为已公开专利和相关大型药企蛋白疫苗的数倍,突破相关疫苗稳定性专利。AI设计的另一条细胞因子管线,在保持抑制肿瘤活性的同时,减毒(减少外周活性)数百倍,猴子实验剂量耐受剂量达到同类管线的数十倍。
困扰产业界数十年的超高难度问题被AI快速解决,AI4S对产业发展的价值日渐突显。在AI技术的驱动下,生物制造领域的革命悄然到来,延续了数十亿年的蛋白进化模式发生了质的改变,蛋白的进化不再是缓慢、充满不确定性的随机突变,转变为基于特定功能的创新式定制。
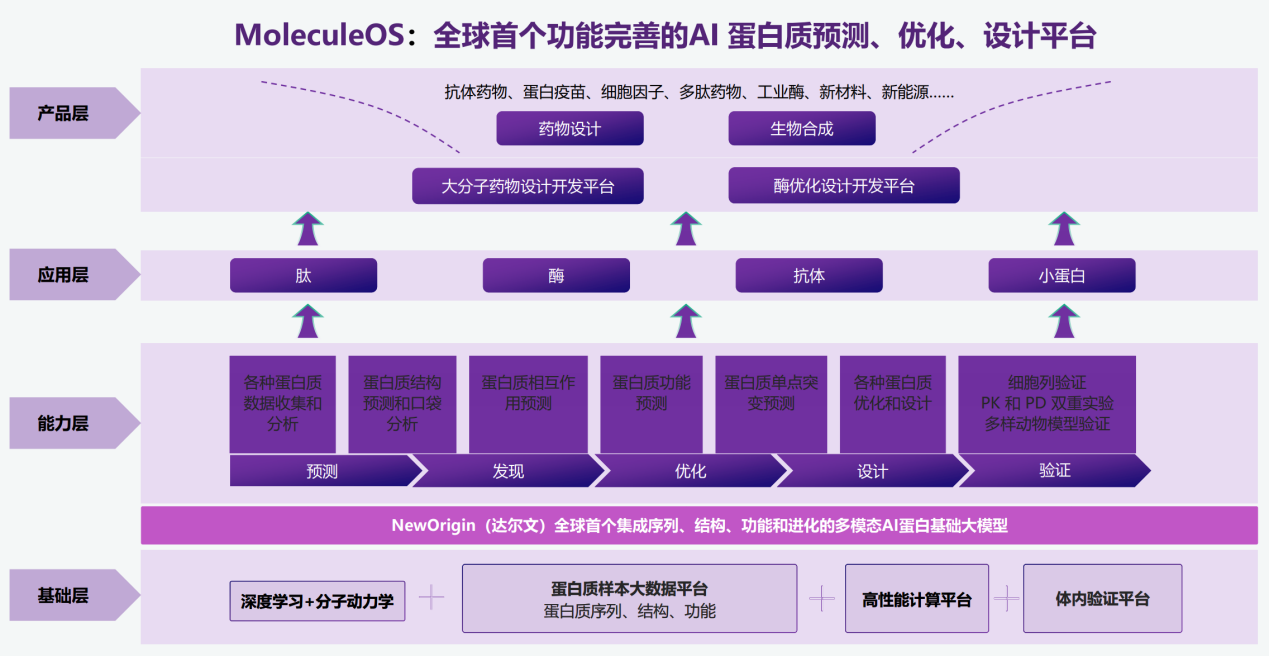
这一变革背后的AI推手是NewOrigin(达尔文)大模型。这是分子之心自主研发的产业级AI蛋白质生成大模型,也是全球唯一一个集成序列、结构、功能和进化的AI蛋白质基础大模型。它拥有百亿级参数,学习了海量高度专业、复杂的多模态数据,可根据产业应用需求,“按需定制”功能性蛋白质。NewOrigin大模型具备高成功率、高普适性、低使用门槛等优势,只需生成几十个分子就能从中获得理想的候选分子,有效规避了传统方法对大规模湿实验的依赖,高效解决生物产业中的蛋白质生成难题。不仅如此,不具备AI算法背景的生物学家也通过对话的形式与大模型进行交互,便捷地获得理想的蛋白质。

目前,分子之心已经将NewOrigin大模型广泛应用于创新药研发、材料、食品、化工、农业等领域,在大分子药物设计、极端环境下蛋白质稳定性优化、酶活性优化、酶-特定底物对接、蛋白质从头设计等多类型的高难度产业任务上取得重大突破,并在真实的生产体系中获得验证。
为加速产业应用,分子之心基于产业项目经验,针对创新药研发、生物制造产业中的经典应用场景,推出五大解决方案。通过深度AI蛋白质大模型与分子动力学模拟、量子化学等科学计算方法,构建端到端、低门槛的产业应用路径:
○ 抗体亲和力优化方案
在创新药研发领域,抗体亲和力优化是提高药物靶向性和疗效、降低副作用的关键因素之一。该方案可以基于AI蛋白质技术预测抗体抗原结合位点,并结合分子动力学模拟与量子化学技术分析抗体与抗原结合过程中的动态变化、评估不同抗体变种与抗原的亲和力,从而指导抗体突变,生成具有更高或更低亲和力的抗体变种。这将有效提升抗体设计成功率,并可大大缩短研发周期、降低研发成本,使药物更快地从实验室走向临床及上市。
○ 极端环境下蛋白质稳定性优化方案
酶、疫苗等蛋白质产品大多需要在特定条件下保存和使用。在高温、高压、强酸、强碱等极端环境下,蛋白质极易失活或变性。该方案基于AI技术和分子动力学模拟,分析蛋白质序列、结构与稳定性之间的复杂关系,并通过预测蛋白质的热力学稳定性参数,如溶解温度(Tm)值、折叠自由能等精准定位影响稳定性的关键残基或区域。进而借助AI算法,在不显著改变蛋白质活性的前提下,提升其对温度、pH值、有机溶剂等环境因素的耐受性,得到稳定性更高的蛋白质。这将有助于将蛋白质应用于更广泛的领域。
○ 酶活性优化方案
酶作为生物催化剂,在工业生产中具有广泛应用。通过AI蛋白质设计技术和量子化学计算,可以精准地预测酶的结构,确定酶的活性中心及催化机制。在此指导下,设计出活性更高、选择性更强的酶。并可同时针对底物结合亲和力、产物释放速率等进行多目标优化,从而以全面优化酶的催化性能,助力产率和产品质量提升,降低生产成本。
○ 酶——特定底物对接方案
酶-底物对接分析是理解酶催化机制、优化酶反应条件的重要前提。该方案基于AI蛋白质技术构建高精度的酶与底物分子模型,模拟酶与底物之间的相互作用过程。同时深入分析了静电相互作用、氢键、疏水作用等多种非键相互作用力,通过模拟捕捉到酶催化过程中的关键中间态,揭示酶促反应的详细机制,从而设计出与特定底物高效对接的酶。这有助于提高催化反应的精准度和效率。
○ 蛋白质从头设计方案
从头设计蛋白质为生物经济的创新发展提供了无限可能。例如,可以设计出具有全新功能的酶、抗体等生物分子,用于疾病治疗、材料合成、石油化工、食品创制、农业生产等领域。通过AI蛋白质从头设计技术,可以根据特定的需求,直接设计出自然界不存在的全新蛋白质,或仅保留功能位点重新设计新的蛋白质结构。分子之心已经运用该技术设计绿色荧光蛋白 (GFP),仅用不到一半数量的氨基酸,就实现了与天然GFP蛋白相似的功能。比ESM3在此方向的探索更早,且使用了更少的氨基酸,设计能力更强。
目前,NewOrigin与这些场景解决方案正逐步集成至MoleculeOS平台中。MoleculeOS是分子之心自研的全球首个功能完善的AI蛋白质预测、优化、设计平台,可以广泛用于多肽、抗体、酶和小蛋白的研究和设计,用生成而非发现的方法设计出具有特定功能的蛋白质产品。持续创新的理念和方法,将为药物设计和生物制造产业带来颠覆性的变革。
技术创新是分子之心的基因。分子之心创始人许锦波教授是全球AI蛋白质领域的领军人物,曾于2016年发明RaptorX-Contact方法,全球首次证明AI可以大幅度提升蛋白质结构预测的精度。CASP(全球最权威的蛋白结构预测比赛)发起人和组织者 John Moult教授表示,这项研究“对该领域影响很大”,它向人们展示了“深度学习在蛋白质上可以做的事情”。Moult如此评价的原因在于,RaptorX-Contact取得颠覆性突破后,谷歌旗下DeepMind受到启发推出AlphaFold,许锦波教授也因此被业界誉为“AI蛋白质折叠奠基人”。
2018年后,许锦波教授进一步扩展研究领域,瞄准更具产业应用价值的蛋白质改造、设计,先后推出了十余项世界领先的技术,比如,首创可同时用于蛋白质侧链预测与序列设计的算法,性能媲美ESMfold的单序列结构预测算法,精度超越AlphaFold 3的复合物预测算法等,并创新性的融合AI与分子动力学、量子化学等技术,解决科学与产业问题。这些技术在测试中表现出了世界领先的性能,相关成果多次发表于科学杂志、美国科学院院刊上,并在湿实验中得到验证,已被国际知名药企、生物科技公司深度应用。
AI正在推动基础科学研究突破,同时驱动前沿科研成果在产业落地应用,加速产业升级。而生命科学是与人工智能结合最紧密、成果最显著的科研领域,也是人工智能技术产业落地的关键领域。英伟达CEO黄仁勋在2024年世界政府峰会上曾表示:“人人都必须学会计算机的时代过去了,人类生物学才是未来。随着新技术和算法的不断改进,人工智能与数据在生命科学领域取得了一些显著进展,在医学、基因研究、药物研发和疾病预防等领域的应用越来越广泛。”
相关文章
热文排行
- . 电视剧《九月鹰飞》编剧 出口公司为亚洲电视有限公司(ATV)
- . 本田DREAMWING CBF 600质量怎么样 发动机选用四冲程水冷
- . 电视剧《猛龙过江》编剧 出口公司为浙江永乐影视
- . 14集电视剧爱情,治愈,美食《没有名字的甜点店》演职员表介绍
- . 49集电视剧都市、情感《爱我,你别走》演职员表介绍
- . 30集电视剧民国/剧情/励志《姑苏十二娘》演职员表介绍
- . 张庭、江宏恩、林炜、王耀庆、梁家榕、席曼宁、李天柱、王淑娟电视剧《太阳花》演员表
- . 瑞奇·热维斯、马丁·弗瑞曼、麦肯锡·克鲁克、露茜·戴维斯电视剧《办公室》剧情简介
- . 李大根、徐承玄、朴世俊、布鲁汀、宫善英、朴勇宇电视剧《真的爱你》剧情简介
- . "为她设计"与可持续发展|sH
- . 5倍提升!NewOrigin大模型突破超难
- . 咖啡经营新思路,猫屎咖啡“零售
- . 中国智造2024完美收官,你将见证
- . 松下纳诺怡技术,带来洁净好空气
- . 海纳数科创新实践成果通过上海市
- . 从飞鹤再次携手抖音「金牌育言家
- . 2023全国冷链百强企业名单揭晓 华
- . 领克07 EM-P通关托底后高空坠落挑
- . 天九共享发布企业家孵化器3.0战略






