重组胶原蛋白行业标准发布,锦波生物人源化胶原蛋白成新趋势
胶原蛋白(简称胶原)是组成人体结构组织的主要蛋白,约占人体蛋白总量的30-40%,是人体组织、器官的主要构成成分,又被称之为“生命之架”。胶原蛋白因易为人体所接受,在医疗健康领域中已广泛应用于人体皮肤、骨、软骨、心血管系统、口腔及管腔组织的修复以及美容整形等领域,随着颜值经济的崛起,胶原蛋白已成医美界新宠。
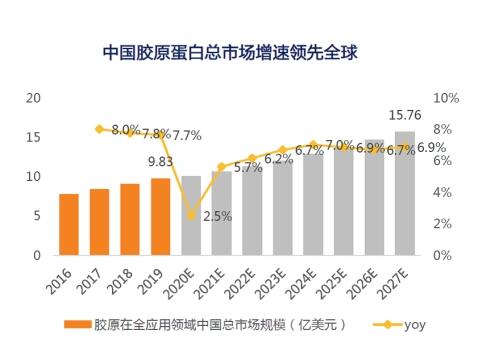
根据 GrandView Research数据,2019年,中国胶原蛋白市场规模约为63.7亿元,占比全球市场 6.40%。预计2027年,中国胶原蛋白市场将高达 201亿元,占比全球市场 6.96%。我国胶原蛋白总体市场规模增速高于全球。
胶原蛋白的提取来源不同主要分为动物源和基因重组。
从世界范围来说动物胶原的应用历史超过110年中国最早在20世纪80年代开始研究动物胶原。受产能、技术等原因活性胶原成本很高难以规模量产化。
而重组法胶原蛋白的提取始于20世纪末,是利用前沿的结构生物学、基因工程等技术以人特定型别胶原蛋白功能区基因编码为模板进行筛选、制备得到与人胶原蛋白氨基酸序列相同或类似的一类新型功效生物材料。由于免疫性低、无病毒风险具有广阔的发展前景。
国家监管部门高度重视重组胶原产业创新发展,为鼓励重组胶原蛋白产业研发创新,推动相关领域高质量发展,自2021年来监管部门陆续发布系列文件,为胶原蛋白产业划分出清晰赛道。
第一步
《命名指导原则》出炉,重塑胶原蛋白赛道细分
2021年3月15日,国家药监局对外发布《重组胶原蛋白生物材料命名指导原则》(2021年第21号通告)

根据《命名指导原则》,重组胶原蛋白分为重组人胶原蛋白、重组人源化胶原蛋白、重组类胶原蛋白三类。但由于生物合成技术水平受限,目前市场上未出现重组人胶原蛋白,只有重组人源化胶原蛋白和重组类胶原蛋白两类产品。
第二步
行业标准落地,“人源化”成产业新趋势

2022年1月18日,NMPA对外发布YY/T 1849-2022《重组胶原蛋白》行业标准。该标准规定了重组胶原蛋白的质量控制要求、检测指标及其检测方法等,适用于作为医疗器械原材料的重组胶原蛋白的质量控制,将于2022年8月1日正式实施。
随着行业新标准的落地,意味着国家对“重组胶原蛋白”市场的政策监管收紧,市场上众多的“不合格”产业也将注定消失。
目前,胶原蛋白原料来源的技术路径主要有三种:
一是动物组织,主要从牛、猪、鼠尾腱、海洋生物等组织内提取,其主要存在问题是免疫反应以及病毒风险。
二是人体组织,主要从婴幼儿包皮、胎盘等,存在来源有限及传染性疾病风险。
三是重组技术制备,分为重组类胶原蛋白和人源化胶原蛋白两类:重组类胶原蛋白是人工合成序列,氨基酸序列与人体差异较大,无胶原蛋白特有的三螺旋结构;人源化胶原蛋白,与人体胶原蛋白特定功能区的氨基酸序列排列和结构100%一致,能够精准重现胶原蛋白本身的功能。
因此,利用生物合成技术制备无免疫原性的胶原蛋白一直是研究的热点,其中利用基因重组技术合成制备氨基酸序列同于人胶原分子功能区的人源化胶原蛋白将成为未来产业发展的新趋势。
百亿市场鱼龙混杂,谁是“合规的重组胶原蛋白”
根据国家药监局对重组人源化胶原蛋白的定义,两个标准是关键:一是由DNA重组技术制备的;二是含有人胶原蛋白特定型别基因编码的全长或部分氨基酸序列片段。
在医疗美容领域,目前境内已批准的填充剂(注射)产品名称包括:重组Ⅲ型人源化胶原蛋白冻干纤维、胶原蛋白植入剂、含利多卡因胶原蛋白植入剂、医用胶原充填剂等。其中,重组Ⅲ型人源化胶原蛋白冻干纤维是目前为止国家药监局第一个发文并认可的,我国自主研制的采用新型生物材料——重组人源化胶原蛋白制备的三类医疗器械产品。
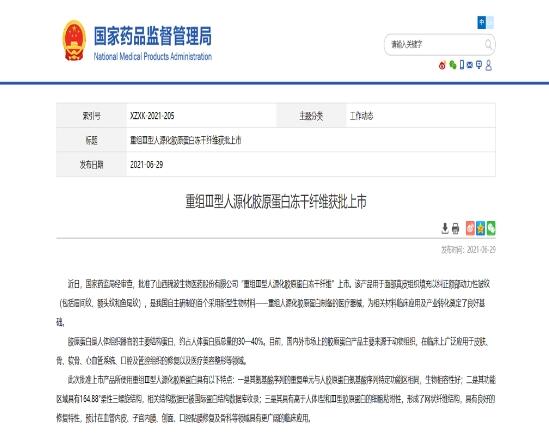
2021年6月29日,国家药监局对外发布消息,批准了锦波生物“重组Ⅲ型人源化胶原蛋白冻干纤维”上市,并阐述了重组人源化胶原蛋白具有以下三大优势:
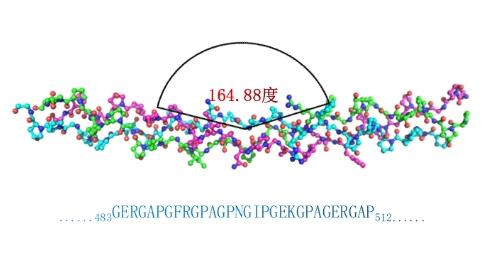
一是其氨基酸序列的重复单元与人胶原蛋白氨基酸序列特定功能区相同,生物相容性好;
二是其功能区域具有164.88°柔性三螺旋结构,相关结构数据已被国际蛋白结构数据库收录;
三是其具有高于人体I型和Ⅲ型胶原蛋白的细胞粘附性,形成了网状纤维结构,具有良好的修复特性,在血管内皮、子宫内膜、创面、口腔黏膜修复及骨科等领域具有更广阔的临床应用。

















